阿尔茨海默病(Alzheimer’s disease,AD)的初期症状通常很微妙:手机找不到了、想不到要说什么,错过了日程……当患者开始为自己的健忘和认知障碍担忧,并寻求医生的帮助时,往往他们脑内的变化已经到了难以挽回的程度。这种最普遍类型的痴呆症目前并没有治愈的方法。
“我们能做的事情不多,目前还没有有效的治疗方案和药物。”来自宾夕法尼亚的专攻神经退行性疾病的行为神经学家里迪·帕蒂拉(Riddhi Patira)说道。
这种局面与人们的预期有所出入。
长时间以来,科学家们都认为在堆积在脑细胞之间的蛋白质是阿尔茨海默病的元凶。但现在,很多研究者开始关注细胞内更深层的功能失调。—Harol Bustos for Quanta Magazine
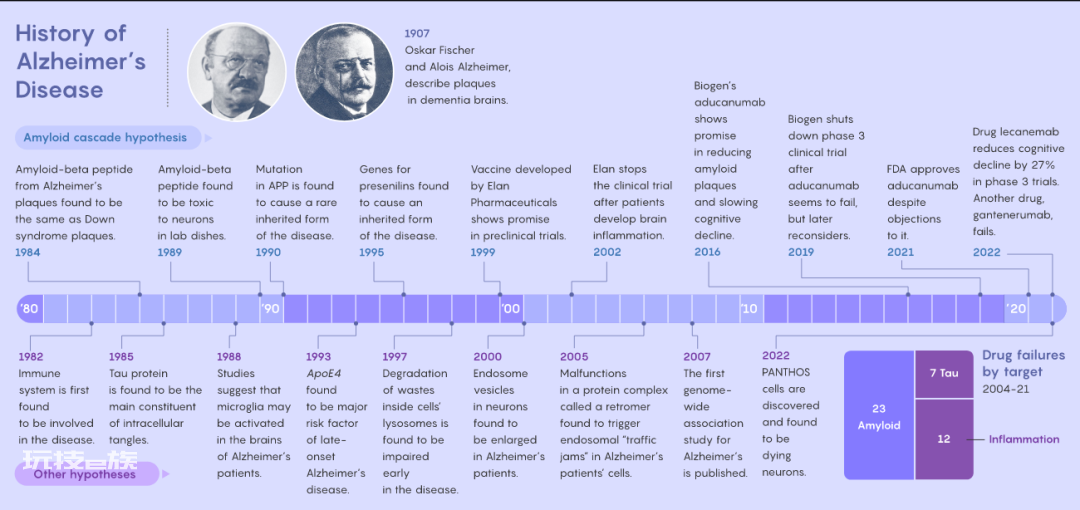
30年前,科学家们以为“淀粉样蛋白级联假说”( amyloid cascade hypothesis)破解了AD的致病机理。这种假说认为淀粉样β蛋白(amyloid-beta,Aβ)在神经元之间形成了黏着的、有毒的斑块,杀死了神经元,并且带来脑内一系列的变化,最终造成脑功能衰退。
Aβ级联假说很简单并且“引人入胜”,哥伦比亚大学的AD研究中心主任斯科特·斯莫尔(Scott Small)如是说。一时间,采用以Aβ为治疗靶点的药物来阻止或减缓AD病程的想法席卷了整个领域。
几十年来,人们在针对Aβ的多种药物成分的临床试验中投入了数十亿美元的资金。但目前没有任何试验表明这些疗法对患者的病情有帮助。
直到2022年9月,制药巨头百健(Biogen)和卫材(Eisai)宣布在Ⅲ期临床试验中,服用了抗Aβ药物lecanemab的患者的认知衰退程度较安慰剂组减少了27%*。12月初,这两家制药公司在旧金山的一场会议上向激动的观众公布了试验数据,目前刊登在了《新英格兰医学期刊》上。
*译者注(https://investors.biogen.com/news-releases/news-release-details/lecanemab-confirmatory-phase-3-clarity-ad-study-met-primary)
来自南加州大学凯克医学院(Keck School of Medicine)的神经学教授保罗·艾森(Paul Aisen)表示,AD病程长达25年以上,希望lecanemab能延缓AD早期患者的病程。这种药物能延缓病程的恶化,让患者能自主生活更长的时间,并且让他们能在失去自理能力之前处理好财务事宜。“对我来说,这非常重要。”他说道。
一些人则并不看好这次试验能取得有意义的进步。“它也难逃失败的命运。”帕蒂拉如是说。
“我们恐怕没有找到在临床上起效的真正重点。”来自华盛顿大学的医学教授埃里克·拉尔森(Eric Larson)表示。从医药公司用来测试药物效力的级别来看——通过对患者以及看护者的采访了解患者的记忆、判断力和其他认知功能——他们的结果虽然在统计上显著,但并不理想。统计显著说明试验结果不太可能是偶然,但并不能和临床上的显著效果等同,拉尔森说道。比如说看护者可能很难察觉到患者的认知衰退的变化速度。
此外,试验中的一些被试报告了脑水肿的症状(尽管制药公司否认是由药物引起的),这引发了一些人对该药物的安全性的担忧。不过相比于成功,失败才是AD药物研究领域的常客,甚至是罗氏制药(Roche)宣布另一种备受期待的药物gantenerumab Ⅲ期临床试验失败的消息,也并未影响人们为lecanemab欢欣鼓舞。
这些结果能说明Aβ级联假说是正确的吗?
并不见得。这些结果的确让一些研究者相信,继续优化针对Aβ的疗法仍然对推进AD的有效治疗有帮助。“我很激动。”来自麻省综合医院(Massachusetts General Hospital)的研究员鲁迪·坦茨(Rudy Tanzi)说道。他承认,lecanemab并不能“从根本上起作用”,但它提供了一种“概念上的证明”,可能潜在地指引更有效的药物的研究,或者被用于更早期的干预以取得更好的疗效。
但很多研究者都不买账。对他们来说,目前的这些以及更早的那些试验中呈现出的小到不存在的效应量,说明Aβ斑块并非AD的病因。斯莫尔认为Aβ“更可能是烟雾(副产物),而火(真正的元凶)还在神经元间肆虐”。
流行假说的困境
纽约的内森·克莱恩精神病学研究所(Nathan S. Kline Institute for Psychiatric Research)老年痴呆研究中心的研究主任拉尔夫·尼克松(Ralph Nixon),对lecanemab平平无奇的疗效既不惊讶也不激动。“如果有人想要印证Aβ级联假说的正确性的话,那么现在他们提出的证据是我能想到的最低水平。”他表示。
从Aβ级联假说最早被提出的时代,尼克松就在AD研究领域苦战。不过他一直在探寻其它(解释痴呆症状原因的)替代性的理论——很多研究者表示,Aβ级假说在缺乏有效结果的支持的情况下仍然受到认可,而很多其他的模型则被很大程度上忽略了,尼克松所带领研究的理论就是其中之一。
最近的一系列研究表明,在AD的诱因中,其它机制的重要性并不比Aβ斑块低。声称Aβ级联假说已死可能有点夸张,来自多伦多的克伦比尔脑研究所(Krembil Brain Institute)的副主任唐纳德·韦弗(Donald Weaver)说道,但“我认为它并不是全部”。
AD的新兴模型比Aβ解释更加复杂,这些理论还未完全成型,因此还不清楚它们会如何转化为治疗方案。但是由于这些新模型关注的是影响细胞健康的基本机制,其研究进展可能会造福多种医学问题,包括衰老带来的一些关键性影响。
当前领域内的很多人(包括那些仍然支持Aβ联级假说的人)都同意在复杂大脑中实际发生的情况没有(该假说描述的)那么简单。曾经无人问津的其它理论如今在领域内逐渐引起了关注。
Karen Dias for Quanta Magazine
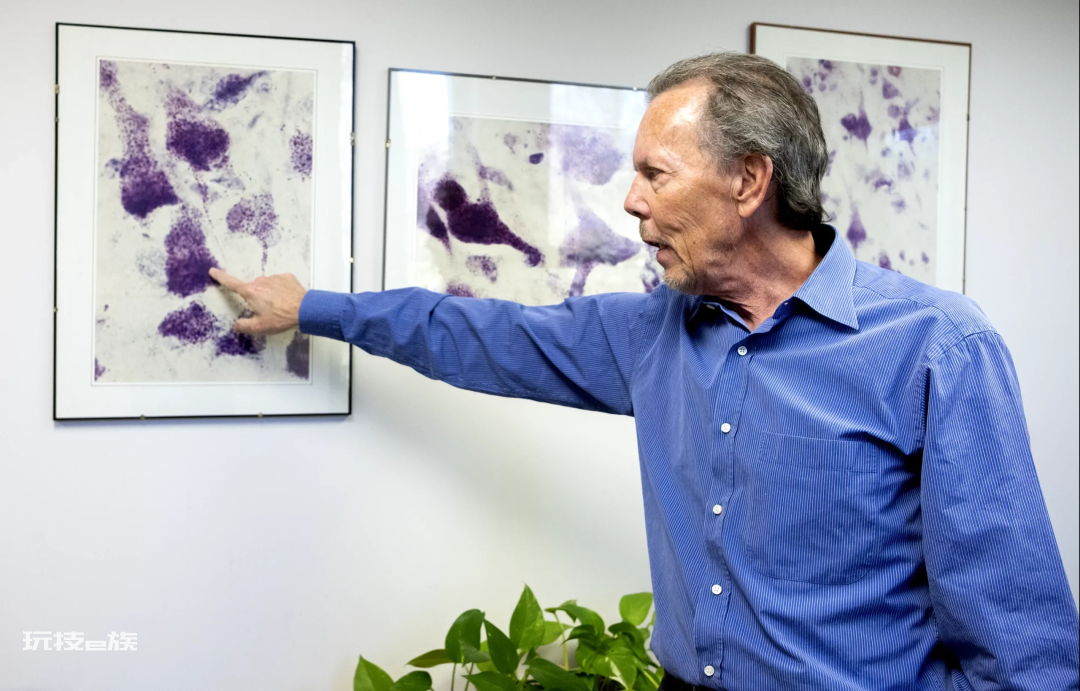
在尼克松办公室的墙上挂着一组裱框的显微镜下照片,图片是大约30年前在他的实验室拍摄的一位AD患者的脑子。尼克松指向照片中的一大块紫色斑点。
“从20世纪90年代至今,我们观察到的现象都是一样的。”尼克松说道。但因为对Aβ斑块的先入为主的观念,他和他的同事没能发现这些斑块的真面目。即使他们发现了,并且告诉了其他人,那“我们当时可能就被踢出领域了。”他说道,“我坚持了这么久,如今终于能让人们相信我所说的事情。”
可疑的斑块
研究AD的科学家们往往对工作投入大量热情,这不仅仅是因为他们的研究关乎重大的健康负担,还因为这种疾病就发生在我们身边。来自西雅图的艾伦脑科学研究所的AD研究者凯尔·特拉瓦格里尼(Kyle Travaglini)就是如此。
在2011年8月的炎热的一天,特拉瓦格里尼作为一名加州大学洛杉矶分校的大一新生,邀请了他的祖父母来学校参观。和祖母在圣地亚哥的日本友谊花园散步,是特拉瓦格里尼少年时代的快乐回忆,因此他希望和祖父母一起在校园里观光。
2015年,当研究者凯尔·特拉瓦格里尼从加州大学洛杉矶分校毕业时,他的祖母因阿尔茨海默病而发生的认知衰退已到了晚期。—Courtesy of Kyle Travaglini
他和他的祖父母在大学校园里巨大的松树间漫步,在开阔的露天广场上穿行。他们在罗马式风格建筑的美丽砖瓦外墙并肩信步。祖父母的脸上洋溢着笑容,每经过一处地方,他的祖母就会问询问,“这是什么建筑?”
然后她一次又一次经过同样的建筑,一次又一次地提出同样的问题。
“那次校园观光是我第一次注意到……似乎有什么不对劲。”特拉瓦格里尼说道。在接下来的几年里,他的祖母通常会将自己的健忘归咎于劳累。“我认为她一直遮遮掩掩的,不想让我们发现(实际状况)。”他说道。最终,他的祖母被诊断为患有AD,正如祖母的妈妈以及全世界其它数千万患者一样。
特拉瓦格里尼的祖母一开始不愿接受自己患有AD的现实,根据帕蒂拉的描述,很多患者都会这样。特拉瓦格里尼说,当他们发现自己什么都做不了时,这种抗拒最终会演变为失望。
年龄变大并不一定就意味着会发展为AD——但老年是最大患病风险因素。并且随着全球平均寿命的增长,AD持续成为主要的公共健康负担,也是现代医学最大的未解之谜之一。
AD一开始表现为记忆受损和认知衰退,最终它会影响患者的行为、语言和方向感,甚至运动能力。因为人脑非常复杂,并且在人脑上做试验基本上不可能,科学家们通常依赖于啮齿类动物的疾病模型,但得出的结果并不总是能迁移到人类身上。另外,AD患者通常还会患有其他类型的痴呆症,因此要厘清与AD相关的脑内变化就更困难了。
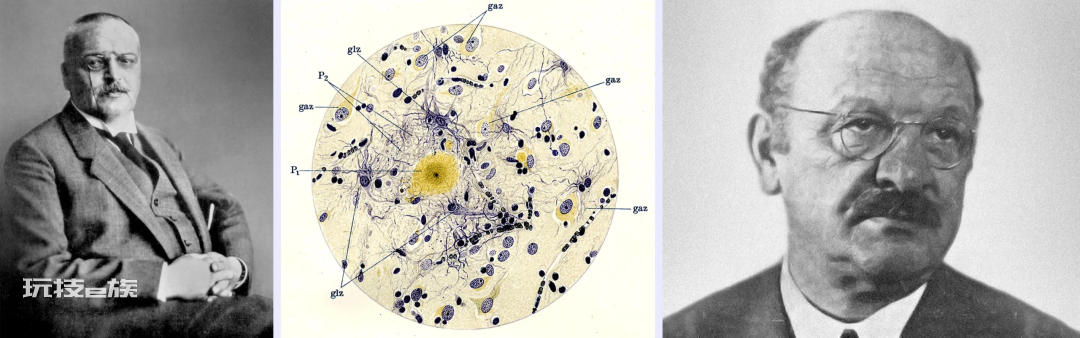
1898年,维也纳大学第二精神病诊所的医生埃米尔·雷德利希(Emil Redlich)首次使用了“斑块”一词,用以描述他在两位被诊断为“老年性痴呆”(senile dementia)的患者的脑组织中观察到的现象。虽然我们仍未弄清AD的病因,但从那时起我们对于这种疾病的了解日益增多。1907年,来自德国的精神病学家阿洛伊斯·阿尔茨海默(Alois Alzheimer)采用银染技术(silver staining technique)在一位55岁死于早老性痴呆(presenile dementia)的名叫奥古斯特·迪特(Auguste Deter)的女性的脑组织中观察到了斑块(plaques)、缠结(tangles)和萎缩(atrophy)的现象。同年,来自捷克的精神病学家奥斯卡·费舍尔(Oskar Fischer)在12例病患脑中观察到了斑块,他把那些斑块称作是玻璃膜疣(drusen,德语中指的是内部嵌有晶体的岩洞)。
从左至右依次为:阿洛伊斯·阿尔茨海默;阿尔茨海默展示的一幅痴呆症患者脑中出现的斑块;奥斯卡·费舍尔。—From left: Science Source; Reprinted from Current Biology, 6/21, Ralf Dahm, Alzheimer’s discovery, 5, Copyright (2006), with permission from Elsevier; Courtesy of Filip em
1912年,费舍尔在许多痴呆症患者脑中发现了斑块,并且对这些患者的病情给出了前所未有的详细描述。彼时,现代精神病学奠基人、慕尼黑精神病诊所的阿尔茨海默病领域领军人埃米尔·克雷佩林(Emil Kraepelin)宣布将这种病症命名为“阿尔茨海默病”。1941年,费舍尔被盖世太保抓捕,在纳粹政治监狱内去世,在这之后的数十年内他本人和他所做出的贡献一直不为人所知。
接下来的几十年里,人们逐渐获得了对这种疾病的更多了解,但它仍然不是主流的研究方向。拉尔森回忆道,20世纪70年代他还是一名医学生,AD仍然被大多数的研究者忽略——和所有关于衰老方面的问题一样。当你年纪变大了,你可能没法记住所有事情,人们对这种现象习以为常。对于衰老疾病的“治疗”令人痛苦。“人们被绑在椅子上,并且服用的药物让他们感觉更糟。”拉尔森说道。大家都认为痴呆只是衰老带来的结果。
但在20世纪80年代,这种想法发生了改变。一系列的论文建立起一个重要的发现:那就是痴呆症老年患者和患有早老性痴呆的年轻患者的脑子看起来一样。内科医生和研究者意识到痴呆症并不是衰老的结果,而是可分离的能够被治疗的疾病。AD开始迎来了关注。“自此之后的几十年来,这一领域的研究者纷至沓来。”拉尔森说道。
最初,关于AD的病因存在一些不完整的、未经检验的理论,从病毒和铝暴露到环境毒素,还有一种叫做加速老化的模糊的观点。1984年这一领域的研究迎来了一个转折点,来自加州大学圣地亚哥分校的乔治·格伦纳(George Glenner)和黄坚(Caine Wong,音译)发现AD患者脑内的斑块和唐氏综合征(Down syndrome,21三体综合征)患者脑内的斑块都是由同样的Aβ构成的。唐氏综合征患者脑内的Aβ形成是基因驱动的,那么AD是否也是一样呢?
这种Aβ从何而来尚不明确。可能它是由神经元自身释放的,又或许它来自身体的其它部位,通过血液进入脑中。但突然之间,研究者找到了随后发生的神经退化的一个嫌疑犯。
格伦纳和黄的论文把一种观点带入了人们的视野:Aβ可能是导致AD的根本原因。直到伦敦的圣玛丽医院医学院(St. Mary’s Hospital Medical School)的约翰·哈迪(John Hardy)实验室发表了一项影响深远的遗传学发现,这一领域的研究者们彻底被点燃了。
23号家庭的诅咒
那是1987年的一个夜晚,哈迪正认真阅读他桌上的一沓信。因为他一直在探索可能导致AD的基因突变,他和他的团队在阿尔茨海默病学会简报上刊登了一则广告,寻求不止有一名成员患有AD的家庭的帮助。因此他收到了这些信件。哈迪开始从上到下依次阅读每一封信件,然而真正改变一切的信件正是他们收到的第一封信——它正躺在这一沓信件的最底部。
“我……认为我的家庭可能会有所帮助。”来自诺丁汉的一名学校教师卡罗尔·詹宁斯(Carol Jennings)在信中写道。詹尼斯的父亲和她的几位叔叔阿姨都在50多岁确诊了AD。研究者让一名护士采集了詹宁及其家属的血样,哈迪在他的工作中将他们的姓名隐去,称之为23号家庭(因为詹宁斯的信件是他读到的第23封)。在接下来的几年内,研究团队对23号家庭的成员进行了基因测序,希望能找到他们共同的基因变异来帮助理解病症的发生。
从左至右依次为:研究者约翰·哈迪,他的关键性工作发现了詹宁斯一家所遗传的早发性阿尔茨海默病与一种基因变异相关;卡罗尔·詹宁斯1986年写给哈迪的那封信;卡罗尔·詹宁斯,她的丈夫和两个孩子,照片拍摄于1992年。—From left: Courtesy of UCL QS IoN Medical Illustration; Courtesy of the BBC and Stuart Jennings; Ross Kinnaird/PA Images/Alamy Stock Photo
在1990年的11月20日,哈迪和他的团队站在实验室里听他们的同事玛丽-克里斯蒂娜-夏尔蒂-哈林(Marie-Christine Chartier-Harlin)报告最近关于基因测序的进展。“当她找到那个基因变异时,旋即我们就理解了。”哈迪说道。在詹宁斯的家庭成员体内,编码淀粉样前体蛋白(amyloid precursor protein,APP)的基因发生了变异,这种蛋白在几年前刚刚被研究者分离出来。正如其名,APP在酶的作用下会分解形成Aβ,编码这种蛋白的基因变异会导致Aβ被过度产生。
那天哈迪赶回了家,告诉正在给夫妻俩的第一个孩子哺乳的妻子,他的研究团队刚刚做出了“会改变人们生活的”重大发现。
几个月后,在圣诞节前后,哈迪和他的团队在诺丁汉一家医院的老年诊室组织了一场会议,会上他们向詹宁斯一家展示了他们的发现。哈迪回忆道,有一位姐妹,一直在说“谢天谢地,我躲过一劫。”但哈迪在与她相处了一会之后发现她明显也患病了;家庭内的其他成员也都知道她患有AD。
詹宁斯一家是温和的宗教信徒,哈迪说道。他们一直认为自己可能是被选中来帮助推进研究的。他们备受困扰,但为自己所做出的贡献感到骄傲——就像是他们应该做的一样,哈迪说。
在接下来的那个二月,哈迪和他的团队在《自然》期刊上发表了他们的研究结果*,让世人了解了APP基因变异及其重要性。詹宁斯一家所患的那种类型的AD比较罕见,在世界范围内的病例大约只有600个家庭。如果亲代中有一人携带这种基因变异,子代会有50%的几率继承并患病——在这种情况下,他们在65岁之前几乎肯定会发病。
*译者注(Goate, A., Chartier-Harlin, MC., Mullan, M.et al.Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer’s disease.Nature349, 704–706 (1991). https://doi.org/10.1038/349704a0)
其他更普遍的AD类型是晚发性的,一般在65岁之后才会发生,没有人知道这种类型的病症与詹尼斯一家所患的遗传性AD在多大程度上类似。
第二年,经过一个长周末,哈迪和他的同事杰拉德·希金斯(Gerald Higgins)提出了一个里程碑式的观点,他们首次使用了“淀粉样蛋白级联假说”这一术语。“我写了一篇在我看来很简单的论文,其中主要的观点是,如果Aβ是导致(23号家庭)这个病例的元凶,那也许它也是其他病例的罪魁祸首。”哈迪说道,“我只是这样写道,然后投给了《科学》期刊,他们原封不动地发表了这篇论文。”他并未预见到这篇论文地影响力会如此之大:这篇论文被引用了超过1万次。这篇论文和之前来自哈佛医学院和波士顿布莱根妇女医院(Brigham and Women’s Hospital)的研究者丹尼斯·塞尔克( Dennis Selkoe)在此前发表的一篇综述成为了Aβ级联这一新假说的奠基文献。
回望这些早期时候,“我以为抗Aβ疗法会是灵丹妙药。”哈迪说道,“如今不管是我还是其他人都不会再这么想了。”
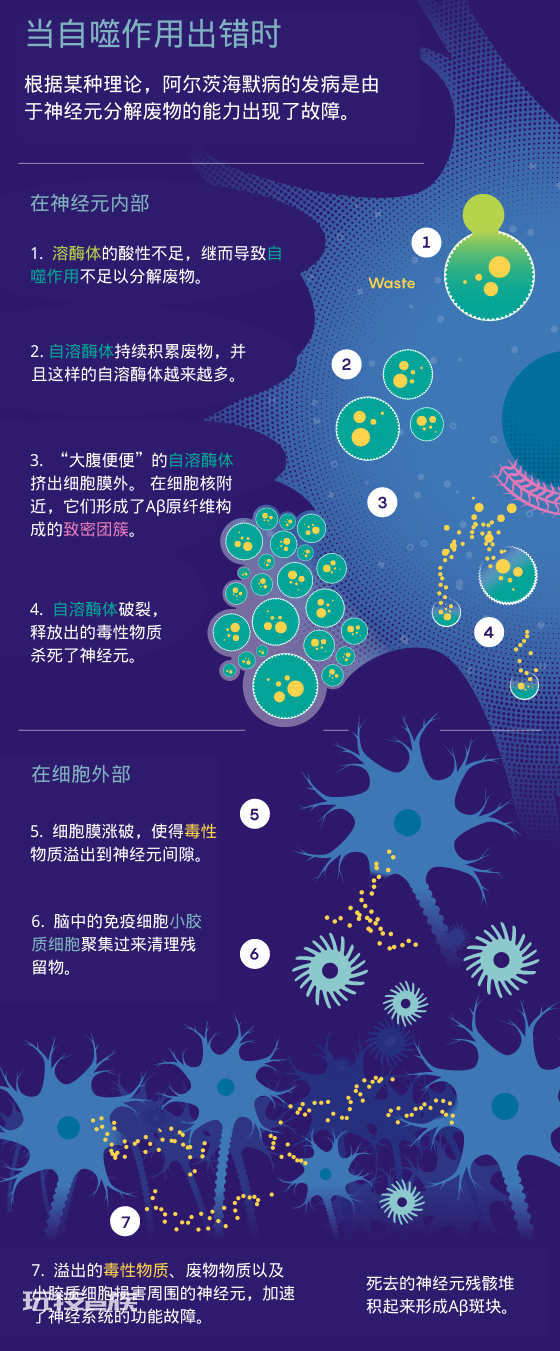
酸液包泄露
研究者们迅速陷入了Aβ级联假说的美丽和简洁中,一个以Aβ为目标并消除它们来拯救AD患者的集体目标开始浮现。
在20世纪90年代早期,AD研究领域变得“思维统一化”,尼克松说道。但他和其它一些人并不信服。(流行的理论声称)已经被分泌的Aβ在细胞之间形成的沉积杀死了神经元,但尼克松认为更可能的情况是Aβ在被分泌之前就在神经元内积累并杀死了神经元。
Aβ级联假说提出以后,AD研究领域变得“思维统一化”,尼克松说道。—Karen Dias for Quanta Magazine
尼克松在哈佛医学院顺着另一种不同的理论的思路开展研究。那时,哈佛拥有美国第一个脑库(brain bank)——当去世者愿意将脑捐献给科学研究时,脑组织会被切片并且在-80℃冰冻以供后续研究。“这是一项大工程。”尼克松说道,正是它将哈佛变成了AD研究的中心。
某天,尼克松打开显微镜观察一片被针对特定酶的抗体染色的脑片。通过显微镜的照明,尼克松观察到这些抗体聚集在细胞外的斑块上。这是一项极其令人惊讶的发现:出问题的这些酶通常只见于一种叫做溶酶体(lysosomes)的细胞器内。“这样的现象说明溶酶体发生了异变,将这些酶泄露了出来。”尼克松说道。
来自比利时的生物化学家克里斯蒂安·德·杜夫(Christian de Duve)在20世纪50年代发现了溶酶体,由于溶酶体在一种至关重要的(但在当时的了解并不多)叫做自噬(autophagy)的过程中发挥作用,人们有时称之为称为“自杀包”(suicide bags)。溶酶体是一种内含酸性浆液的膜囊泡(membrane vesicles),浆液中的酶能分解不再被需要的分子、细胞器等,包括可能具有潜在危害的错误折叠蛋白质以及病原体。自噬是必不可少的过程,但与身体其他部位的细胞相比起来,这一过程对神经元尤其关键,因为成熟的神经元不会分裂和更替。他们必须要保持存活。
附近的神经元是否发生了衰退,将酶泄露出来?神经元是否完全被分解?不管实际发生了什么,尼克松发现的现象提示人们斑块并不仅仅是在神经元之间累积并杀死神经元的Aβ的产物。在神经元内部可能有什么环节出错,差错甚至可能发生在斑块形成之前。
但塞尔克以及哈佛的其它同事并没有像尼克松一样被这一关于溶酶体的发现振奋。他们并非反对尼克松的观点,但是他们选择固守原有的理论。APP基因的命名者坦茨是第一批分离出这种蛋白的研究者,此后成为了Aβ级联假说热切的拥趸者,尼克松甚至还担任过坦茨的论文委员会的委员。
“我们这些人都是朋友……只是我们持有不同的观点。”尼克松如是说。他回忆道他们曾经祝贺这份研究做得不错,但同时也委婉表示“我们个人不认为这项发现比Aβ级联假说更接近AD的真相。老实说我们并不关心这一结果”。
沉默的异议
尼克松并非是唯一一个发展Aβ级联假说的替代性理论的人。一些研究者认为问题出在tau蛋白的缠结(tau tangle)上——这种神经元内的异常的蛋白质束同样也是AD的特征,它与认知方面症状的关系甚至比Aβ更紧密。另外一些人认为可能是过度或不当的免疫活动引起了脆弱的神经组织的发炎和受损。还有一些人开始怀疑是胆固醇代谢过程或给神经元供能的线粒体出现了异常。
但尽管有这些替代性理论存在,一直到20世纪90年代末,Aβ级联假说仍然是生物医学研究机构的毋庸置疑的宠儿。基金机构和制药公司开始壕掷数十亿资金投入抗Aβ的疗法和临床试验中。至少从基金资助的对比来看,那些替代性理论显得默默无闻。
Merrill Sherman/Quanta Magazine
为什么会这样是一个值得思考的问题。虽然Aβ级联假说的主要部分仍谜团丛生,例如Aβ从何而来,它们又是如何杀死神经元的,但假说的观点在某种程度上来讲指向了具体的富有前景的方向。它指向了一种分子;它指向了一个基因;它指向了一种策略:消除这些斑块来停止疾病的进程。对于每个渴望结束AD所带来的折磨的人来说,至少它提供了行动的方向。
相比之下,其它的理论还相对处于未成型阶段(很大程度上是因为它们不太被关注)。一边是追寻基于淀粉样蛋白的治愈方法,另一边是探求一个模糊的除了Aβ以外的什么东西,医学和制药界做出了看上去更理性的抉择。
“就像是在进行一场理论达尔文,赢得竞争的理论会进入测试阶段。”哈迪说道,“而Aβ级联假说正是那个冠军。”
2002-2012年间,48%的在开发的AD药物以及65.6%的临床试验集中在Aβ上。而只有只有9%的药物以tau缠结(人们认为除了Aβ以外唯一可能的其它致病原因)为目标。其它的一些候选药物则旨在起到缓冲作用,在病程开始后减少神经元受到的损害。Aβ级联假说的替代性理论几乎无人问津。
要是那些针对Aβ的药物真的有效就好了。
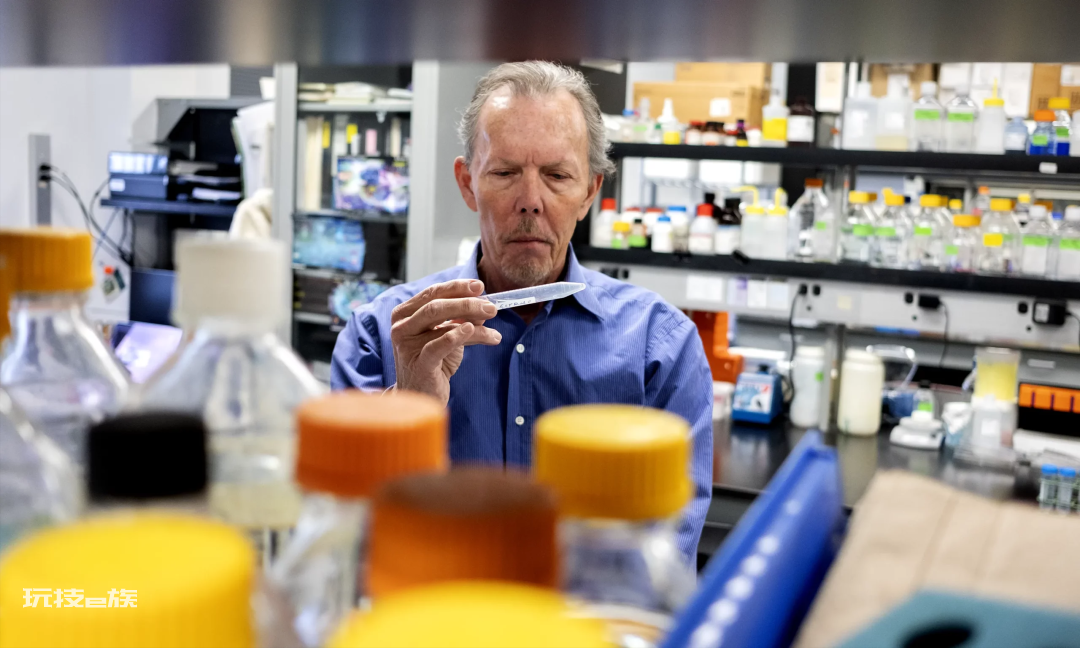
在尼克松位于内森·S·克莱恩精神病研究所的实验室里,他和他的同事菲利普·斯塔夫里德斯在观察阿尔茨海默病患者脑组织的显微镜下影像。—Karen Dias for Quanta Magazine
希望化为泡影
没过多久,关于药物试验和Aβ假说的实验验证的结果带来了铺天盖地的失望。1999年,义隆(Elan)制药公司研发出了一种用以训练免疫系统攻击Aβ蛋白的疫苗。然而在2002年,该公司终止了试验,因为一些接种了疫苗的病人出现了危险的脑炎症状。
在接下来的几年内,几家公司测试了用以对抗Aβ的合成抗体的效果,发现它们对AD病人的认知功能毫无改善。其它的还有一些针对催化酶(帮助APP蛋白分解为Aβ)的药物试验,以及一些尝试清除患者脑中既存斑块的试验——无一例外地宣告失败。
截至2017年,已有146种治疗AD的候选药物被宣判无效。只有4种药物获得了许可,但这些药物都是用于治疗疾病引发的症状而非针对潜在的病理。这些结果累积的失望越来越多,在2018年,辉瑞(Pfizer)公司宣布退出AD的研究。
一篇2021年的综述比较了14个主要的试验结果*,证实了减少胞外的Aβ并不能很大程度上改善认知功能。另外,还有少量失败试验是针对例如炎症和胆固醇之类的Aβ以外的目标,不过对于这些替代Aβ理论的研究本身就较少,因此失败也少得多。
*译者注(Ackley, Sarah F., et al. “Effect of reductions in amyloid levels on cognitive change in randomized trials: instrumental variable meta-analysis.”bmj372 (2021).)
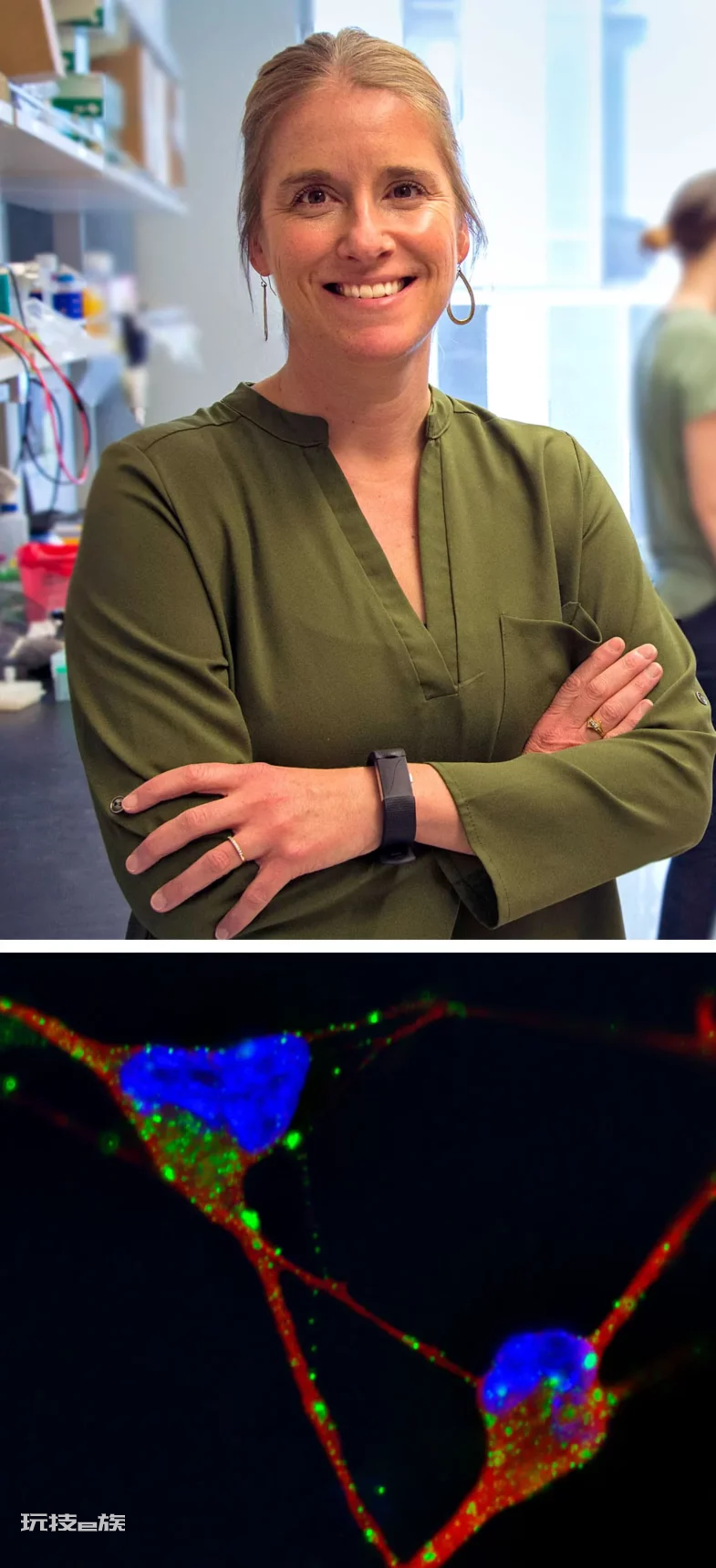
杰西卡·杨( Jessica Young)的研究可能导致或促成阿尔茨海默病的细胞内体-溶酶体通路的功能障碍。下图为阿尔茨海默病患者干细胞研究的显微照片,其中的绿点为神经元内扩大的核内体。—From top: University of Washington; Allison Knupp/Young Lab
“这样的结果太令人郁闷了。”来自华盛顿大学的副教授杰西卡·杨说道。她刚开始求学时,先是研究细胞生物学,然后转向神经生物学,最后她把精力投入到了AD相关的研究中,她眼看着一个又一个临床试验以失败告终。这会“让那些真正想要去做出改变的年轻科学家们感到沮丧”,她说道,“他们可能会困惑,我们要如何攻克这个问题?所有的尝试都无效。”
曾经AD领域也迎来过短暂的光明。2016年,百健公司研发了一款叫做aducanumab的药物,研究者在《自然》期刊的论文中报告了该药物的早期试验结果*,表示它对于消除Aβ斑块以及减缓AD患者的认知衰退有良好的前景。
*译者注(Sevigny, J., Chiao, P., Bussière, T.et al.The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease.Nature537, 50–56 (2016). https://doi.org/10.1038/nature19323)
但在2019年,百健公司终止了aducanumab的临床三期试验,表示这种药物并没有效果。次年,在重新分析数据后,百健公司表示aducanumab至少勉强在一部分患者中通过了一次试验,公司向美国食品和药物管理局(Food and Drug Administration,FDA)申请批准该药物的使用。
尽管科学顾问认为aducanumab的风险远大于其效用,FDA还是在2021年批准了aducanumab的使用。甚至是一些Aβ假说忠实的拥趸者都不满这项决策。aducanumab并未被同意纳入美国国家老年人医疗保险,所以只有那些参与试验或者能负担得起自费购买的人们能接受aducanumab的药物治疗。在全球的研究以Aβ假说为中心发展了30年后,aducanumab仍是唯一一种获得批准的试图从神经生物学原理上减缓病程的药物。“你的假设可以很完美,但如果没有治疗效能,那它就毫无用处。”尼克松说道。
“再试一次”
当然,这些临床试验的失败,并不一定意味着它们所基于的科学理论是错误的。事实上,Aβ假说的支持者经常提出争论,认为参与试验的患者接受抗Aβ药物干预时的病程已经太晚,因此导致了治疗的失败。
这种辩护的问题在于没人知道是什么导致了AD的发生,所以人们不可能知道应当在多么早期的时候进行干预。风险因素可能在你50岁之后出现,也可能是15岁。如果这种疾病的风险发生在生命的非常早期,那怎么确定它们是几十年后发生的症状的病因呢?
“Aβ假说一直在演化,所以每当有一些发现对假说的一些方面提出质疑时,它就会做出相应的修改。”尼克松表示。但是基本的前提没有变过,那就是胞外的Aβ斑块是所有其它病理的诱因。
对于替代性理论的研究者斯莫尔来说,一些屏息等待着鼓舞人心的结果出现的Aβ假说支持者,已经“不再是冷静公正的科学家,而更像虔诚的信徒”,他说道,“他们陷入了这种自证性的世界,总是期待‘再试一次’。但这样没有科学意义。”
另外,斯莫尔注意到,在药物试验苦苦挣扎的同时,新的科学发现正在打破最基本的假设。例如,在尸检中发现脑内存在严重的Aβ沉积的死者生前并未患有痴呆症或其它认知障碍,神经影像学研究也提供了佐证。
这一不符合预期的结果提醒人们关注到一百多年前阿尔茨海默提到的“解剖不匹配”(anatomical mismatch)现象。AD的神经病理开始于两个脑区——海马及其附近的内嗅皮层——通常Aβ的积累量是最少的*。而Aβ斑块的沉积最先发生在额叶皮层,这一区域在疾病的更晚阶段才病变,并且并不会有太多细胞死亡,斯莫尔说道。从Aβ刚出现到tau沉积,再到神经元死亡和认知衰减,这些过程之间可能隔着几十年——让人不能确定这些现象之间是否存在因果关联。
2022年7月,Aβ假说又遭受了一记重创:刊登在《科学》期刊上的一篇重磅文章**,揭露了影响广泛的那篇将Aβ斑块和AD中认知症状建立联系的2006年《自然》期刊论文可能存在数据造假。正是那篇《自然》论文所报告的二者之间的联系让当时很多研究者坚持追随Aβ假说。对于很多这些研究者来说,这场新的揭露使得Aβ假说被撕开了一个很大的缺口,帕蒂拉说道。
*译者注(Alzheimer, A. über eigenartige Krankheitsfälle des späteren Alters.Z. f. d. g. Neur. u. Psych.4, 356–385 (1911). https://doi.org/10.1007/BF02866241)(Lesné, S., Koh, M., Kotilinek, L.et al.A specific amyloid-β protein assembly in the brain impairs memory.Nature440, 352–357 (2006). https://doi.org/10.1038/nature04533)
杰西卡·杨的研究方向是可能导致或共同导致阿尔茨海默病发生的细胞内核内体-溶酶体通路的功能异常。在她从阿尔茨海默病病人上提取的干细胞的显微影像中,绿色的点代表着神经元内变大的核内体。—Merrill Sherman/Quanta Magazine
艾森承认科学应当鼓励研究者们选择不同的道路。“但在学术医学和商学领域,每个人都肯定会在很大程度上受到结果的影响。”他说道,“职业生涯取决于结果。”
Aβ假说带来的影响更是巨大的。研发一种AD药物平均需要耗费十年多的时间和57亿美元的资金。“制药公司毫不避讳地表示他们在这方面投入了几十亿美元。”
也许是由于那些大量的投入以及Aβ假说带给公众关注的期望,即使在假说的失败记录摆在面前的情况下,一些研究者仍然很难接受现实。
2015年,当特拉瓦格里尼进入斯坦福大学时,作为一年级研究生的他被AD相关的研究所吸引,并以此作为他的博士论文的主题。这种选择似乎自然而然:他的祖母被官方诊断为AD,并且他曾投入大量时间搜遍医疗文献,寻求可能会帮助到她的信息。他向教授细胞生物学课程的两位教授寻求建议。
“他们的意思是,‘不要做与之(AD)相关的课题。’”特拉瓦格里尼说道。他们向他担保AD的问题基本上已经解决了。“应该是Aβ的原因。”他回忆起他们的话,“在未来的两三年里应该就会出现有效的抗Aβ药物,不要担心。”
特拉瓦格里尼询问的第三位教授同样告诉他要避开AD的问题,并非因为它马上就要被解决,而是因为“它太过于复杂”。不如尝试解决帕金森症(Parkinson’s disease,PD),那位教授说道:科学家们在PD方面的洞察力更强,而且相关的问题也简单得多。
特拉瓦格里尼搁置了要研究AD的计划,将论文方向转为绘制肺图。那些钻研AD的非Aβ的研究方向的研究者们表示他们遭遇了很大阻力。有许多人“受到了Aβ派的压迫”,斯莫尔如是说。他们得不到津贴和经费——总之,他们在追寻自己理想的理论过程中受到了阻碍。“那时候想要发出不同声音的人会感到很受挫。”韦弗说,为他的非Aβ课题申请经费经历了“一场艰难的斗争”。
当来自德克萨斯大学圣安东尼奥分校的教授乔治·佩里(George Perry)提出了“Aβ来自神经元内部”的理论时,“这个观点普遍不讨喜。”他说道,“由于申请不到经费,我不得不停止了这项研究。”
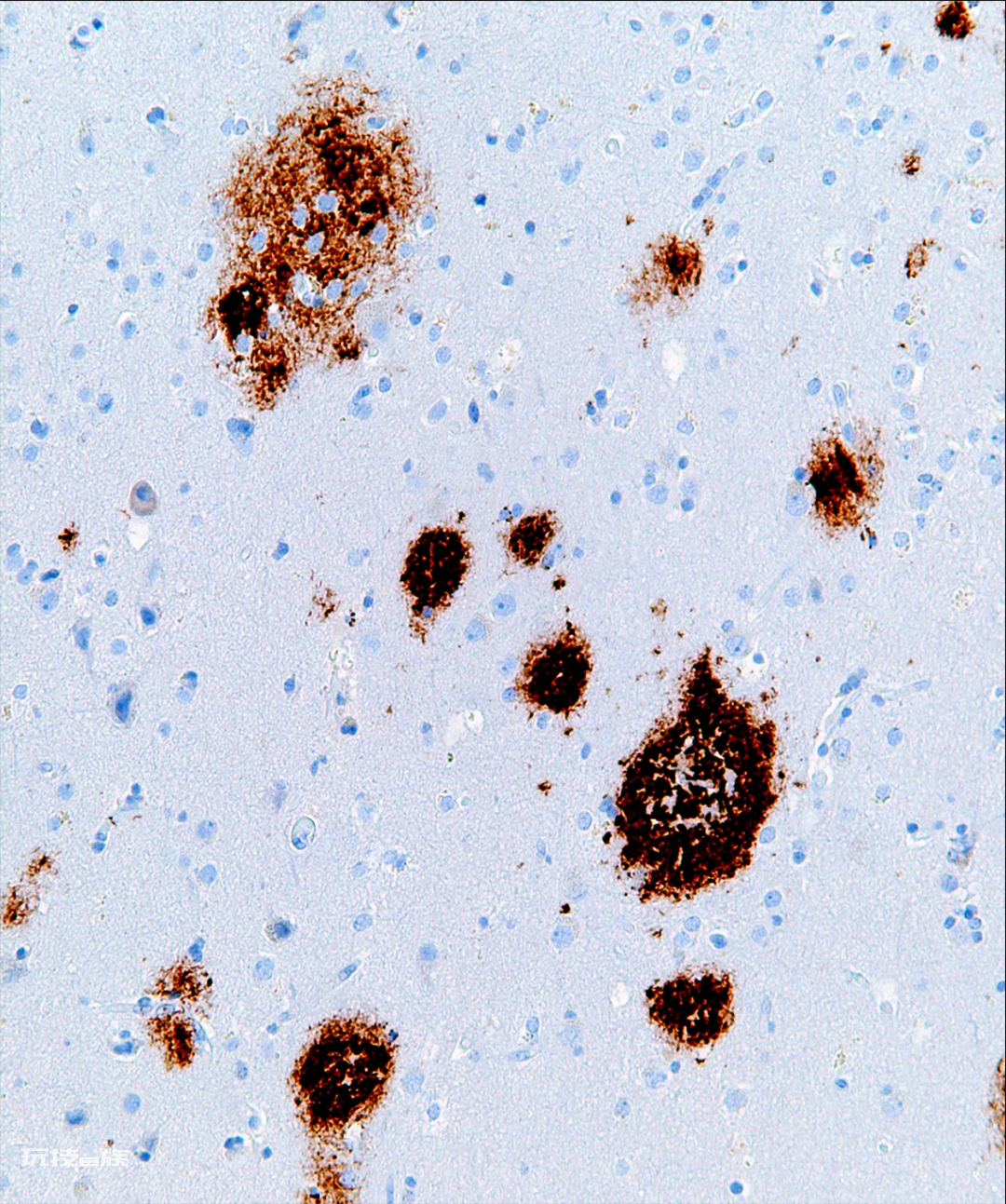
脑组织中细胞外的Aβ斑块(深色纤维)是阿尔茨海默病的一个特征。—Nephron
“这并不是什么(为了阻止替代性理论的)宏大阴谋”,来自伦敦大学学院的干细胞生物学教授里克·利弗西(Rick Livesey)说道。但是他提到“在痴呆症方面的研究领域存在一些革新方面的问题”。
2016年,德国美因茨约翰内斯·古腾堡大学医学中心的生物化学教授克里斯蒂安·贝尔(Christian Behl)跨出了大胆的一步,组织了一场名叫“除了Aβ之外”的会议,对于AD成因的新观点进行开放式的讨论*。“我收到了好些Aβ领域之外的同僚的不满意见,他们并不赞许举办这样一场会议。”他说道。
*译者注9https://www.unimedizin-mainz.de/pathobiochemie/research/behl-group.html?L=10
变大的核内体
尽管遭遇挫折,一些非Aβ研究在21世纪初仍然取得了阶段性的进步。尤其是在千禧年之际,一项至关重要的发现让溶酶体相关的解释重振旗鼓。
尼克松实验室的一名博士后研究员安妮·卡塔尔多(Anne Cataldo)当时正在哈佛的捐赠大脑中研究一种叫做核内体(endosome)的细胞器的性质。核内体在细胞膜下方形成了高度动态化的囊泡网络,辅助溶酶体的功能。核内体的职责是从胞外摄入蛋白质及其他物质,将它们分类,并且运输到他们需要去的位置——有时候会去到溶酶体进行自噬。(把核内体想象成细胞内的快递员,杨如是说。)
卡塔尔多发现AD患者的脑中,神经元内的核内体异常之大,就像是它们竭力要加工它们运输的蛋白质一样。如果那些准备要被破坏的分子没有被正确地标记、回收或运输,这种核内体-溶酶体通路的扰乱会引发细胞内外的一连串问题。(想象那些没未被分类和投递的包裹堆积在快递卡车上。)
有两点证据表明核内体变大的现象并非是大脑不断病变的结果:(1)除了AD患者之外,这种现象并未在研究者观察的其他神经退行性疾病患者的脑内发生;(2)核内体的增大发生在Aβ斑块沉积之前。
“这是一项非常关键性的发现。”尼克松说道。
此外,卡塔尔多在一些携带有APOE4基因变异(影响机体处理胆固醇)的、还未出现AD症状的人们的身上也观察到了核内体发生。APOE4在此前被发现是对于晚发性AD最重要的基因风险因素。(在漫威超级英雄电影中饰演雷神的演员克里斯·赫姆斯沃思最近被发现携带有此基因。)携带一个APOE4基因副本的人发展为AD的风险会升高2-3倍;像赫姆斯沃思这样携带两个基因拷贝的人的患病风险则会提升8-12倍。
卡塔尔多、尼克松和他们的同事在2000年发表了他们的发现*。从那时起,陆续有证据表明溶酶体功能损害存在于从神经退行性疾病到“溶酶体贮积症”(lysosomal storage diseases,表现为毒性分子在溶酶体中堆积而不是分解)等疾病中。研究者还发现,神经元中的APP分解产生Aβ的过程发生在核内体。有研究发现,在衰老的细胞中,核内体-溶酶体系统的运行常常会减缓以及出现故障——这一现象使得这些细胞器成为了寿命研究领域的热门话题。
*译者注9Cataldo, Anne M., et al. “Endocytic pathway abnormalities precede amyloid β deposition in sporadic Alzheimer’s disease and Down syndrome: differential effects of APOE genotype and presenilin mutations.”The American journal of pathology157.1 (2000): 277-286.0
尼克松猜测核内体-溶酶体通路、Aβ级联、神经炎症和其他过程都属于他有时称之为“大象”的阿尔茨海默病疾病模型的一部分。—Karen Dias for Quanta Magazine
卡塔尔多于2009年去世,尼克松实验室及其合作者们关于核内体的工作停滞了。但斯莫尔和他的团队当时正沉迷于这一研究领域。在2005年,他们发现在AD中*,特定的核内体中的一种叫做逆转录酶(retromer)的复合蛋白质可能发生了故障,引发了核内体的交通事故进而导致Aβ在神经元内堆积。
*译者注(Small, Scott A., et al. “Model‐guided microarray implicates the retromer complex in Alzheimer’s disease.”Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society58.6 (2005): 909-919.)
遗传学的说服力
在哈迪等人的实验室内,遗传学实验曾将Aβ理论推向焦点;而在过去的15年内,同样是遗传学实验推动了替代性理论的发展。“遗传学绝对是给事物赋予意义的利器。”利弗西说道。
从2007年开始*,大量的基因组统计研究发现了与AD相关的许多新的基因风险。这些基因的影响效力远比APOE4弱,但它们的确会增加AD的患病概率。这些基因还将晚发性AD与一些细胞中的生物化学通路(包括免疫系统、胆固醇代谢和核内体-溶酶体系统)直接关联起来。在AD中最早被激活的基因很多都包括在前述的那些基因中。人们正是从这些(遗传学)发现开始相信“(此前发现的现象)是有意义的。”尼克松说道。
*译者注9Shen, Luxi, and Jianping Jia. “An overview of genome-wide association studies in Alzheimer’s disease.”Neuroscience bulletin32 (2016): 183-190.)
核内体-溶酶体假说不仅逐渐变得具体;它越来越像是AD谜题中至关重要的一块拼图。
-Ohoud Al AlShaikh-
但是,Aβ级联假说的支持者仍然认为遗传学站在他们那边。已知的直接导致AD的基因(而不仅仅是增加患病风险)的3个基因分别编码APP蛋白(祸害詹宁斯一家的元凶)、早老素1和早老素2——这三种基因的变异都会导致Aβ堆积。
“任何看到这样的结果,还不承认Aβ就是病因的人要么就是逃避现实,要么就是不够坦率。”坦茨如是说,“遗传学会让真相大白。”
不过研究同样表明,那些基因还可能以并不遵循Aβ假说的另外的方式和疾病相关联。例如,在2010年,尼克松和他的团队报告了早老素1基因变异会损害溶酶体的功能*。还有证据表明,上述三种基因都与核内体膨胀有关。
*译者注(Lee, Ju-Hyun, et al. “Lysosomal proteolysis and autophagy require presenilin 1 and are disrupted by Alzheimer-related PS1 mutations.”Cell141.7 (2010): 1146-1158.)
关于如何解释目前的研究发现的争论依然很激烈,但很多AD领域的研究者感到了一股暗流涌动,那就是领域内的观点正倾向于认同“Aβ并非不重要,但它并不是全部”。尼克松说道,“现在已经有足够多的人(支持替代性理论的观点),我认为这传递的信息是,‘现在施展拳脚吧’。”
痴呆症之花
尼克松的桌上放着一份《自然-神经科学》的6月刊,旁边的马克杯是那份刊物的封面研究的第一作者送给他的,上面印着封面图。
那一期的封面是尼克松和他的团队所做的研究,他们报告了在神经元内部更深处发生了本质性的功能障碍,这是证明简单版本的Aβ级联假说是错误的最有力证据之一。如果他们在后续的研究中得到与这些小鼠及人类研究一致的发现,那么他们可能很大程度上会改变我们对于AD起源的理解。
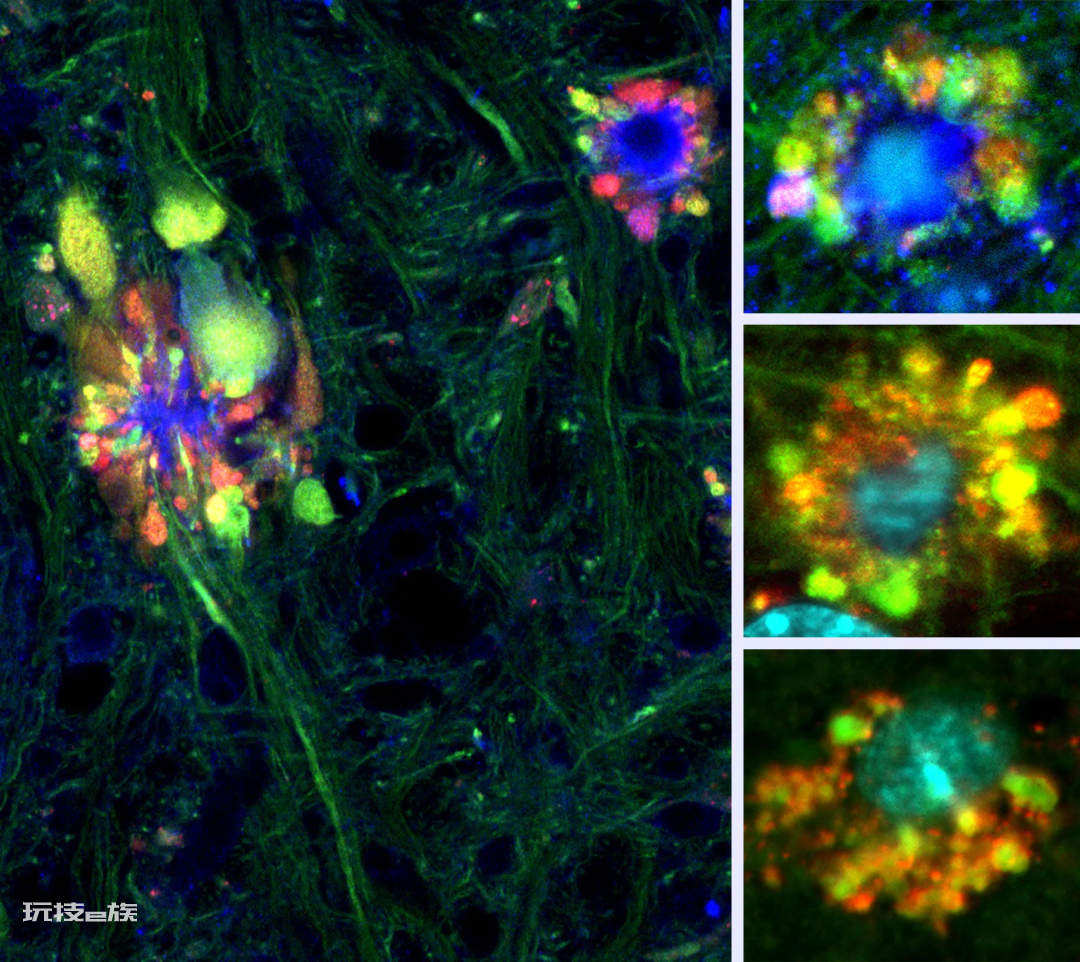
他们用遗传学手段诱导小鼠发展出AD,并采用一种新型荧光探针标记了它们体内参与自噬作用的溶酶体。这种探针让研究者能在活体小鼠上通过大型的共聚焦显微镜观察疾病的进程。显微镜下观察到的第一个结果是“我们采集到的最壮观的图象。”尼克松说道,“这是我从未见过的新世界。”图像上能看到脑中的结构就像花朵一样。
这些“花朵”其实是由于毒性蛋白和分子的累积在神经元周围形成的隆起。经过会议商讨,研究团队决定将这些神经元称为“PANTHOS”,这个词源于古希腊中表示花朵的词汇ánthos,另外加上了字母“p”来代表有毒。
尼克松和他的团队发现溶酶体的功能异常会导致受疾病影响的神经元膨胀成他们称之为PANTHOS的结构。在显微影像中,PANTHOS神经元看起来和花朵惊人相像,但他们实际上是走向死亡的细胞。—Ju-hyun Lee
后续的更多研究解释了PANTHOS神经元是自噬作用发生错误的产物。通常在自噬作用中,携带着消化酶的高酸性溶酶体会与携带废弃物的囊泡相融合,形成自溶酶体(autolysosome)。在其中,废弃物会被分解接着被回收进入细胞内。然而,在AD的小鼠模型中,Aβ蛋白和其他废弃蛋白会在自溶酶体中积累。溶酶体和自溶酶体的酸性不足以让消化酶分解这些废弃物。
神经元中不断出现这些自溶酶体,它们膨胀得越来越大。很短的时间内它们就会向外挤压细胞膜,形成尼克松所观察到的那样的“花瓣”。大腹便便的自溶酶体还会在神经元中积累,它们和其他的细胞器融合并逐渐形成一堆堆淀粉样纤维直到变成斑块的样子。
最终,自溶酶体会胀开,释放它们内部的毒性酶,损害并渐渐地杀死细胞。死去的细胞的内容物泄露到了周围的环境中——开始毒害周围的细胞,形成新的PANTHOS神经元——直到爆炸。小胶质细胞是脑中免疫系统的一部分,它们此时加入收拾残局,但在这个过程中它们也开始损害周围的神经元。
尼克松和他的合作者们还意识到了另外一件事:采用传统的染色和成像手段,PANTHOS神经元内部那些在自溶酶体里积累的蛋白质看起来正和经典的细胞外Aβ斑块一样。细胞外的Aβ斑块并没有杀死细胞——因为那些细胞已经死亡了。他们的发现说明抗Aβ治疗方法只会是徒劳。“这就像是试图给一个已经入土的人治病。”尼克松说道,“移除斑块只是挖走了墓碑。”
因为他们最初的发现是在小鼠上进行的,研究团队试图在人类组织样本上寻找类似的PANTHOS神经元。有了明确的目标之后,他们轻而易举就找到了。巨大的共聚焦显微镜占据了尼克松实验室那间黑暗和布满灰尘的房间的一半,研究科学家菲利普·斯塔夫里德斯(Philip Stavrides)坐在控制端,上下调整显微镜的视野,观察人类AD患者的脑组织样本。明亮地绽放着的绿色、红色和蓝色的毒性“花朵”充满整个荧光屏。
Merrill Sherman/Quanta Magazine
“这篇论文真的非常有趣,并且离病因又近了一步。”来自阿姆斯特丹大学医学中心的神经化学教授夏洛特·特尼森(Charlotte Teunissen)如是说。了解AD的早期损害的机制能帮助药物的研发,并且还有利于确定生物标记(biomarker),她补充道。这篇论文“是杰出的”,佩里表示。
长久以来,人们为哪种形式的Aβ最具有毒性,以及它们在哪里造成大部分损害的问题争论不休。这项研究提供了充足的证据说明细胞内的Aβ在AD中起着重要作用,艾森说道。在令人感兴趣的是,他说,神经病理学家们要去检查AD患者的脑内发生这些异常的频率有多高以及范围有多广。对于药物治疗方面的研究,他认为现在“有更充分的理由去继续探寻一些能进入细胞内并降低产生Aβ的酶活性的小分子”。
从这篇PANTHOS论文发表以来,尼克松和他的团队可能进一步发现了AD患者脑内的溶酶体无法正常进行酸化过程的原因。当APP在核内体中被分解时,这个过程的副产物之一就是Aβ,而另外一种是被称为β-CTF的蛋白质。过多的β-CTF抑制了溶酶体的酸化系统。因此,β-CTF可能是一直被忽略的另外一个药物研发的潜在靶点,尼克松说道。
大象之全貌
在尼克松发表了那篇PANTHOS论文之后一周,他和其他几位研究者因为提出了超出AD主流理论的新颖洞见,在德克萨斯大学圣安东尼奥分校被授予了奥斯卡·菲舍尔奖(Oskar Fischer Prize)。
这一奖项原本是打算授予那个对AD病因提出最全面解释的人。但最终设立者将它分成了多个奖项,因为对于这样一种复杂的疾病来说,“不可能捕捉到它的各个不同方面”,尼克松说。
尼克松因揭示了核内体运输蛋白质以及溶酶体清除蛋白质的功能出现故障而获奖。其他人则是因为胆固醇代谢异常、线粒体、神经干细胞和神经元标识相关的工作而获奖。关于病理事件发生顺序的假说是模糊的;对于什么先发生什么后发生,可以有各种论据。但所有功能异常的通路——包括核内体和溶酶体、免疫系统、胆固醇代谢、线粒体,神经干细胞和其他的——都可能是组成那幅错综复杂的庞大拼图中的几块。
尼克松说:“在我看来,这些所有的研究都能被整合成一个总体,我称之为大象。”例如,核内体-溶酶体的功能障碍很容易就会影响所有其他的通路,并且将损害遍及每个细胞和整个脑。但如果功能障碍之间存在错综复杂的联系,那么AD就不存在单一的确定性的诱因。
其他研究者也开始不再将AD当作一种单独孤立的疾病,而认为它是各式各样的过程一起出错的结果。如果这种观点是正确的,那么针对这一连串事件采用单一一种蛋白质来进行治疗,例如淀粉样蛋白,可能不会带来很大改善。但是复合药物——比如说,一种成分针对大象的腿,一种针对它的尾巴,另一种针对它的鼻子——可能会有足够击倒这庞然大物的能力。
尼克松希望能找到除了Aβ以外的在核内体-溶酶体功能异常中起主要作用的蛋白质。—Karen Dias for Quanta Magazine
有太多人仍旧坚持把关于AD病因的争论当作一个二选一的问题,尼克松说道。他们斥责尼克松,争论说他提出的核内体-溶酶体机制很重要的观点就表示他认为Aβ在AD中没有作用。他说:“这就像是你不能持有两个相关的并列观点。”在AD中,Aβ可能是一个致死因,但可能还有其他一些同样重要的毒性蛋白的积累也能杀死细胞,他说道。尼克松表示:“Aβ就像是一个垃圾桶里的香蕉皮。还有大量其他垃圾可能比香蕉皮更恶心。”
斯莫尔同意如果能将核内体-溶酶体假说、神经炎症假说和Aβ级联假说整合成一个更大的理论是最有意义的。“你可以用奥卡姆剃刀原则来想这件事。”他说道。这种更广泛的视角的包含的内容可能已经超出了AD的领域。从AD中获取的线索可能可以帮助理解其他的神经退行性疾病,例如PD和肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS,或称卢伽雷氏病)——以及衰老。反过来说也成立:韦弗也经常阅读ALS和PD相关的文献,希望其他领域的洞察“能迁移到我们领域。”他说道。
流行假说新药物
与新理论的困境
对于除Aβ级联假说之外的解释的热忱,并不影响人们对目前测试中的抗Aβ药物感兴趣。艾森和许多其他研究者依然对lecanemab能取得一定成功持乐观态度。即使这种药物仅能解决AD中发生的一部分故障,任何进步对于患者来说都是一条救生索。
“患者们不能什么(治疗措施)都不做。”韦弗如是说,“我真心希望这些想法中能有一个起到效果。”
在这张显微影像中洋红色的结构勾勒出的是脑中的免疫系统中的一个小胶质细胞内的溶酶体。溶酶体内部的绿色部分是这个细胞在清除受损的神经元时吞噬的突触物质。—Javier Rueda-Carrasco/Soyon Hong lab/UK DRI at UCL
在经历了多年的药物研发失败之后,lecanemab的试验结果对于哈迪来说是一个好消息。他从伦敦飞往旧金山,为了出席在11月底进行的AD的临床试验会议,会上将展示试验的结果。他本可以呆在家里从线上观看结果,但他想要在现场分享那种兴奋,以及“去听听其他人如何看待这些结果”。
纵然几十年前参与了Aβ级联假说的提出,并且至今仍相信它,哈迪也总是非常乐于接纳不断发展的新观点。
2013年,哈迪和他的团队发现一个参与免疫系统的基因变异可能提高晚发性AD的患病风险。从那时起,他就把实验室的研究重心转移到了小胶质细胞上。他猜测Aβ沉积可能会直接激活小胶质细胞,进而导致损害性的炎症反应。
对于很多研究者来说,免疫系统为AD提供了一种具有吸引力的灵活的解释,它和Aβ假说以及其他观点都吻合。2020年7月发表在《柳叶刀》期刊上的一篇研究报告列举了目前已知的痴呆症风险因素的种类,从空气污染到重复性头部创伤(repetitive head trauma)再到全身感染。韦弗说:“它(痴呆症的情况)在不停地发生变化。”
韦弗继续说,将这些线索串联起来的就是免疫系统。如果你撞到头使得脑组织受损,免疫系统就会参与进来收拾残局;如果你被病毒感染了,你的免疫系统也会被唤醒去对抗它;空气污染也会激活免疫系统并且导致炎症。有研究表明甚至社会隔离也会导致脑炎,抑郁症也是一种已知的痴呆症风险因素,韦弗说道。
免疫系统还与溶酶体系统有内在联系。“细胞如何运用溶酶体系统来内化、分解或回收蛋白质对于会发生怎样的神经免疫反应至关重要。”杨说道。
但同时,核内体-溶酶体网络又非常精密,并且包括在不同类型的细胞中起到不同作用的许多部件。这使得要以它为靶点更加棘手,杨说道。但她仍然对于接下来几年内会涌现的针对这一网络的新临床试验满怀期待。杨,斯莫尔和尼克松目前都在针对这个网络的不同方面开展研究。
Aβ级联假说的一部分美丽,就是它为AD提供了一个简单的解决方案,而其他假说有的则引入了额外层面的复杂性,但现在科学家们——还有越来越多的创业公司——似乎都愿意去应对这种复杂性了。
等待救赎
特拉瓦格里尼在博士工作的后期又重新回到了AD研究领域。在2021年的10月,他在艾伦研究所开始他的工作,仔细观察由于阿尔茨海默病去世的患者的脑组织样本切片。他和他的团队目前在汇编西雅图阿尔茨海默病细胞图谱*(Seattle Alzheimer’s Disease Cell Atlas)——可用于参考这种疾病对于脑内多种细胞造成的影响的细节。他们正在分析皮层内一百多种细胞在AD病程中的活动变化,这是该项工作的一部分。
*译者注(https://portal.brain-map.org/explore/seattle-alzheimers-disease)
“这种疾病的细胞层面研究很重要,因为所有这些分子层面的变化和假说最终都需要放入到疾病真实发生的细胞环境中。”特拉瓦格里尼表示。如果你将Aβ或者tau蛋白放在培养皿的细胞上,细胞就会开始恶化、死亡。“但不同种类的细胞是如何发生变化的还并不那么清楚。”
特拉瓦格里尼已经在他的研究中发现了有趣的现象,例如脑内最容易被AD损害的是那些在皮层内形成格外长程连接的神经元——而这正是我们许多认知功能的基础。那类神经元的某些特征使它们更容易被这种疾病影响,他说道。
特拉瓦格里尼和他的合作者们还观察到了一些细胞数量的增多,例如小胶质细胞,这更佐证了神经炎症是病程中的主要部分。他们还发现了AD患者脑内有一些基因的表达存在异常,包括与核内体-溶酶体网络相关的基因。最终,他们的工作也许会帮助人们理解特定细胞功能发生紊乱的时间点,解开关于AD的最大谜题之一。
凯尔·特拉瓦格里尼,他的兄弟科林和他的祖父母。—Courtesy of Kyle Travaglini
特拉瓦格里尼尝试尽可能经常地去拜访他的祖父母。前一阵子,他的祖母需要搬进陪护型的记忆之家;他的祖父也会一起去。“他想要陪她一起。”特拉瓦格里尼说道。
自他们在费城念大学的时候两人就形影不离;祖父在日本服驻外兵役期间他们结了婚,到现在已经超过60年了。他看着她每况愈下总是感到煎熬,而最近甚至更糟——他也被诊断患有痴呆症,虽然不是AD。他会深情地谈起她,但会接着补充说“她不再那么爱我了”。特拉瓦格里尼说道。家人会提醒他那不是真的,只是因为她生了病。12月1日的清晨,特拉瓦格里尼的祖母过世了,享年91岁。
特拉瓦格里尼的祖母的AD发展得严重到她不能理解自己的孙子在研究什么,但是他的祖父至少还有机会知道特拉瓦格里尼在痴呆症领域开展研究。“他为此感到由衷的骄傲。”特拉瓦格里尼说道。
家庭的支持对于像特拉瓦格里尼这样的研究者在各种意义上都很重要。数百万家庭志愿参与测试新药物以及推动理解AD的新想法,即使他们明知道这些结果不太可能很快实现应用转化来帮助他们自己。
直到找到有效的治疗方法之前,帕蒂拉会继续以她的方式对待痴呆症患者们,一直握着他们的手,帮助他们适应与家人之间不断变化的关系。她的患者们最恐惧的莫过于认不出他们的孙辈。“这种疾病对于自身和所爱之人都是折磨。”她说道。
当前领域内对于其他替代性理论的态度更加开放了,各种研究会在有好有坏的消息中继续推进。“即使是研究结果并不理想,你至少能从失败中学到点什么。”帕蒂拉如是说,“对于临床医生来说,这很令人沮丧;但对于科学来说这是好事。”
“卡罗尔知道这意味着什么”
在哈迪发现APP基因就是詹宁斯一家深受AD所害的原因后不久,卡罗尔·詹宁斯辞去了教师的工作,开始全职支持和维护关于AD的研究。在接下来的几十年里,她先后与哈迪以及伦敦大学学院的其他研究者密切共事。
卡罗尔·詹宁斯和斯图尔特·詹宁斯,他们是为阿尔茨海默病研究作出卓越贡献的志愿家庭之一。—Courtesy of Stuart Jennings
APP基因导致了詹宁斯一家11人中的5人患有AD:詹宁斯的父亲、三位阿姨和一位叔叔。但詹宁斯没有进行APP基因变异的测试。“她认为检测没有意义,因为我们束手无策。”卡罗尔的丈夫斯图尔特·詹宁斯(Stuart Jennings)说道,他是一名卫理公会牧师和历史学家。“她会说,‘我可能明天就被大巴车撞倒了;为什么要担心30年之后的事情呢?’”他们的两个孩子可能也不会去做检测。
2012年,卡罗尔·詹宁斯58岁,被诊断为AD。
像卡罗尔·詹宁斯这样能让研究者观察并且确切告诉她为什么她的脑功能会发生故障的人只是非常小的一部分。大多数AD患者的疾病并不能和一种特定的基因建立联系,对他们的脑内变化的解释则更具开放性。
“有趣的是,早期的症状影响的是那些她原本就做不好的事情。”斯图尔特·詹尼斯如是说,“我们以前经常调侃她从卧室到洗手间都会迷路。”最后这种调侃成真了。她一直是个很拖延的人,而今变本加厉。
接下来,那些她擅长做的事情,像是收拾行李和组织事情,也开始出现问题。中间经过了几年的时间她才正式确诊,那之后的头几天真的非常煎熬,斯图尔特说:“卡罗尔很清楚这意味着什么。”
于是她开始交代后事。她告诉斯图尔特,她去世之后,她的脑子必须要捐赠给伦敦大学学院研究团队的脑库,和她之前饱受折磨的家人们一起;她告诉他,如果应付不来的话可以不必把她留在家里,但必须要保持她的卫生——她把一切都事无巨细地安排妥当了。“她真的很棒,把一切安排得井井有条,我只是提供支持。”斯图尔特说道。
他设法将她留在家里照顾,而伦敦大学学院的研究者继续跟踪观察詹宁斯的家庭。卡罗尔和斯图尔特的儿子也和他们密切共事。
当卡罗尔患感冒卧床时,斯图尔特会坐在卡罗尔旁边,有时轻抚她的头。由于AD的影响,她无法下床,也无法跟别人交谈,只能在提示下给出是或不是的回答。在对话中,卡罗尔时睡时醒——但当她醒着、看着采访者的时候,她看起来是那么生动。
也许在那些时刻,她的思绪回到了在台上讲解AD的时候,那时候她能轻易地表述,给观众带来启迪和震撼。在她的讲话中,她会着重提出“这件事不是关于试管和实验室,而是关于家庭。”斯图尔特说道,“我想,这样的观点对医药代表来说极具感染力。”
改变AD的治疗方法没能及时出现帮助卡罗尔,对此她并没有感到苦恼——对于她来说,这并不是最重要的。“卡罗尔一直秉持着的工作信念是,这些研究是为了孩子们、为了下一代而做的。”斯图尔特说道。
后记
老司橘:这篇长文比较详尽地梳理了AD研究历程中重要的发现,以及随之不断发展的理论。长久以来,AD都是最重要的公共卫生议题之一,在如今全球人口老龄化趋势下,神经退行性疾病的诊疗方面的突破更显得迫在眉睫。Aβ级联假说曾经振奋人心,也曾让研究者们屡屡碰壁,曾经被挤占研究资源的替代性理论如今终于赢得了一席之地。在翻译这篇文章的过程中,我的心绪也跟随着AD研究的发展而起伏,并且为愿意献身研究的志愿者的精神而感动(或许是为后代奉献的善良,或许是由于人类对病魔的不屈服)!另外,我尊敬那些坚持发展替代性理论的研究者,同样也尊敬那些(诚实地)捍卫Aβ级联假说的研究者——良性的争论即是科学发展的活力源泉。衷心希望良性的理论发展能早日为AD患者带来福音。
Soda:我愿称这篇文章为阿尔兹海默研究的最全编年史,亦是一部跌宕起伏千回百转的文字纪录片。不过,这篇文章再长,也长不过人类对于攻克阿尔兹海默病的漫长的努力与期待,希望「大象之全貌」可以早日被看见。
本文来自微信公众号“神经现实”(ID:neureality),作者:Saplakoglu。